Az élelmiszer-koncentrátumok életképességének ellenőrzése során a savasság az egyik fő jelzés, amely a szirovin és a késztermék jóságát jellemzi. A savasság is összefügg a főbb tényezőkkel, amelyekre közvetlenül megítélhető a kharchokoncentrátum és a zöldségszárítás biokémiai és fizikai-kémiai folyamatai.
A gyakorlatban a kontrollt a savasság jelzi, vagy titrált, és aktív, azaz. vízionok koncentrációja - pH (psh).
Jelentős savasság
Erős savasság esetén minden sav és beszéd termékének ki lehet téve, amely a rétről reagál. Jelentős savasság figyelhető meg a következő értékekben:
vіdsotkakh for masa (vagovih), hogy savról van-e szó, ami fontos ebben a termékben (tej, citrom, almasav és benne);
"fokon", tobto. milliliterben 1 n. réten, amelyet savanyú talajok semlegesítésére használtak 100 g terméket.
A peevicsav tüdejében a savasság megnyilvánulása esetén a milliliterek mennyisége 0,1 csillag. Rétek, vitracheno a savanyúság semlegesítésére 100 g termékben, szorozzuk meg a vizes sav miliekvivalensével. A teljes savasság meghatározható a termékben lévő vizes oldatok széles skálájával végzett titrálással, a fermentáció szintjét megváltoztató indikátor jelenlétében, vagy potenciometrikusan elektrometriás titrálás módszerével.
A savasság meghatározása titrálással
A készítmény cym savasságát a fogyóeszközök vizes kivonataiban vagy a "bovtanci" szerint határozzák meg.
A vízhuzatban a savasságot úgy határozzák meg. A végtermék természetétől és a perfundált savasságtól függően a részletezett termék tömegét körülbelül 10 g mennyiségben kell figyelembe venni (a pontozás pontossága 0,01 g-ig). Helyezze át a navazhkát egy 250 ml-es lombikba, öntsön 200 ml desztillált vizet, és infundálja 30 percig gyakori visszafolyatás közben. Helyezze a lombikot a jelig desztillált vízzel, jól keverje össze, és szűrjön át egy száraz lombikot papírszűrőn. Pipettával adjunk hozzá 20-25 ml szűrletet, öntsük át a végső lombikba, és titráljuk 0,1 N-vel. egy növekvő réten jelenléte közelében 3-5 csepp fenolftalein a rozs-farbuvannya. A kivonatok elkészítése után 2-3-szor hígítjuk desztillált vízzel.
A savasság növekedése a képlet után

de V - mennyiség pontosan 0,1 n. titrálásra ment rétek, ml; K - a vidpovidinsav törési együtthatója. Tejsav K esetében - 0,0090, citromsav - 0,0064, almasav - 0,0067, borkősav - 0,0075, olasav - 0,0060; g - a késztermék tömege, g; V1 a titráláshoz vett szűrlet mennyisége, ml.
Ha a savasságot a mért termék „bowtanz”-ja szerint határozzuk meg, 5 g-ot 0,01 g-os pontossággal áttöltünk a 150-250 ml-es zárólombikba, majd öntsünk 30-40 ml desztillált víz előtt. Lombik helyett 2-3 percig kell nyújtani, amíg a termék kialakul. A finom részecskéket a lombik falához tapadva desztillált vízzel mossuk, 5 csepp 1%-os fenolftaleint adunk a palackba, és 0,1 n-el titráljuk. rózsás rét. A titrálást megfelelően (különösen reakciók esetén) kell elvégezni, a kúpok állandó ismétlődő feltöltésével, egészen addig, amíg egy fényes erysipelas-tel teli, amelyről nem ismert, hogy 1 percig nyúlik, megjelenéséig.
A savasságot, amelyet fokban adnak meg 100 g vrobiv (x), a következő képlet alapján számítják ki

de V - mennyiség 0,1 n. a rét mérete, a titráláshoz szükséges mennyiség, ml; 20 - pererahunka együtthatója 100 g virobira; 10 - együttható pererakhinka 1 n. nyissa meg a rétet.
A párhuzamos találkozók eredményei közötti különbség 0,5°-kal túlbecsülhető. Az elektrometriás titrálás módszere zastosovuyut schodo savasság _intenzíven zabarvlenih chi kalamutnyh razchinіv.
A savasság hozzárendelése elektrometriai titráláshoz
Vіn zasnovanі a vznacheni elektroprovіdnostі doslіdzhuvannogo rozdzhuvannoy titrаnіy rozanіy yogi rét által titrálva. A két főelektródából álló galváncella lándzsája potenciálkülönbségből adódik, ha az egyik elektródán a normál tartományban, semleges reakcióval, a másikon a kiegészítő tartományban van zavar. A rózsás réten a vizsgált fajta titrálásával a potenciálkülönbség csökken. A semleges pont elérésekor a potenciálkülönbség nullával egyenlő, a lándzsán lévő ütés ismert, az indikátorelektróda potenciálja megegyezik az elektróda potenciáljával. Vіdsutnіst struma vstanovlyuyut galvanométer galvanіchnogo elem tartalmazza a lándzsát.
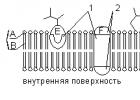
Az elektrometriás titráláshoz használjon speciális berendezést vagy tartozékokat a pH (psh) mérésére: IM-2M, LP-58 (16. ábra, a), LPU-01 (16. ábra b) és in. A speciális telepítés sémája az ábrán látható. 17. Ez a rögzítés egy 250-300 ml-es zárólombikból áll, a jakba három nyílású dugót helyeznek. Az egyik nyílásba 1-es csappal ellátott üvegcsövet helyeztek (cső átmérője 0,8-1 cm, hossza 15-20 cm).
A csőhöz öntsünk 5-8 ml 0,01 n semlegesített, dús kálium-klorid oldatot. rózsás rét fenolftalein jelenlétével a gyenge erysipelas fertőzésig. A cső csap alatti vége is okolható a KCl adagolásáért, hogy a cső körül ne legyenek izzók. Az 1 csőnél a humuszgyűrű segítségével helyezzen be egy platina elektródát 2, a másik lyukba helyezzen be egy platina elektródát 3; a harmadik nyílásnál - bürettadobás, mintha rózsás rétre emlékeztetne. A segédvillogó rúd egyik elektródája közvetlenül a 4 galvanométer egyik érintkezőjéhez csatlakozik, a második elektróda az 5 távírókulcshoz, majd az utolsóhoz megyünk a galvanométer utolsó érintkezőjéhez.
Ha a végső lombik ki van jelölve, vigyen át 25-50 ml további kérget, ha szükséges, a lombikban lévő kéreg térfogatát 50-60 ml-re állítsa fel frissen forralt desztillált vízzel. A natív helyen lévő lombiknál adjunk hozzá kinhidront (10-20 mg) egy kés hegyéhez, és óvatosan keverjük össze. A quindiron troch-okat szintén egy kálium-kloridos csőbe kell hozzáadni, és platina elektródával össze kell keverni. A lombik parafával van lezárva, és az elektródák végei a hibásak, de a közepén zanurenny. Ezután a harmadik nyílást behelyezzük a 0,1 N méretű büretta fúvókájába. réteken. Az 5-ös gomb megnyomásával megváltoztatják a henger jelenlétét a lándzsában, és visszahúzzák a galvanométer nyilait.

Ezt követően a lombikot 0,1 N-vel titráljuk. rózsás rét, kevés rózsa hozzáadásával a réthez, és a lombik helyett schoraz zbovtuyuchit. Ezután rövid svéd ruhokkal nyomjuk meg a gombot, és jelezzük a galvanométer nyilak ruhját. A titrálás végéig cseppenként adjunk különbséget a réthez. A titrálást azért fontos befejezni, mert a réten megmaradt cseppek növekedése után a struma nem jelenik meg a lándzsában. Milliós mennyiségért 0,1 csillag. rozmenu rét, sho pіshov titrálás, razrakhovuyut savanyúság ízletes formulához

A lombik elkészítése után az elektródcsövet desztillált vízzel alaposan mossuk. Abban az időszakban, ha az elektróda savasságát nem mérik, az elektródát desztillált vízbe kell meríteni.
Aktív savtartalom (pH)
Az aktív savasság a vízben lévő aktív ionok koncentrációjától (pH) függ. A vízirózsákban lévő savak, rétek és sók a víz H és hidroxil-BIN ionjaivá disszociálnak", így a savasságot vagy a vízben vagy a hidroxilben lévő ionok jelenléte jelenti.
Ugyanabban a térfogatú semleges különbségben azonos mennyiségű ion, víz és hidroxid van. A vízionok koncentrációja a tiszta vízben tizedik logaritmusként jelenik meg, negatív előjellel, és a pH (pH) szimbólum jelzi. A kémiailag tiszta víz semleges reakciójú, pH-ja lg10-7 = 7.
Savas közegben a vízben lévő ionok száma nagyobb, mint a hidroxidban lévő ionok száma, és a pH-érték (pH) kisebb lesz, mint 7. A tócsás közegben a hidroxidban lévő ionok meghaladják a vízionokat a vízionokhoz képest, a pH-érték érték nagyobb lesz, mint 7.
Az aktív savasságot elsősorban az elektrometriás módszerrel határozzák meg speciális tartozékok - potenciométerek - segítségével. A pH orientációs hozzárendelésével speciális indikátorpapírokkal, kiegyenlítési skálával lehet hámozni. Ehhez az indikátorpapíron alkalmazza a fajták tesztelését, és az erjedésnek megfelelően határozza meg a pH-értéket, porivnyuyuchi otrimane zabarvlennya zі porіvnyannia skálát.
Elektrometriás () pH-meghatározási módszer. Az elektrometriás módszer a bázisok pH-értékének meghatározására a galvanikus elem vimiryuvannі elektrostruzhіynoї ї erőn (e.d.s.), a fő elektróda, a zanurirovanny in doslidzhuvaniya razin és a porіvdenyania npіvelementi (standard elektrosztuniania) réséből választva. A potenciometrikus módszer lényege abban rejlik, hogy a fémelektróda földelésekor, hogy ugyanazon a fémen megbosszulják, az ioncsere után az elektródát feltöltik és egy új elektromos potenciálon, melynek értéke lerakódik. a kiskereskedelemben a meta lu ionok koncentrációjában.
Az elektrodestruktív erő leküzdése két módszerrel lehetséges: érzékeny voltmérő segítségével és kompenzációs módszerrel. Az első módszer az, hogy voltmérővel csatlakoztatjuk mindkét elektródát, amely az e.r.s értékét mutatja. elem. Ez a módszer kevésbé pontos; Vimir e.d.s. kompenzációs módszere. legpontosabb arra, amit e.d. a következő elemről, amely a lándzsában lévő strumot hívja, hogy összehasonlítsuk az f.s. nagyságának egy másik nézetével.
A gyakorlatban a pH (pH) szabályozását speciális eszközökkel - potenciométerekkel - szabályozzák, amelyek elektromos áramkörének alapja a vimir e.m.f. kompenzációs módszere. Ezeknél a tartozékoknál a reochord alatti ár millivoltban vagy pH-egységben van kalibrálva. Millivoltok e.d.s. fordítsa le a speciális táblázatok pH értékéből.
A legnagyobb széles szélességű nabulát ilyen potenciométerekkel készítették: P-4, LP-5, PPTV-1, LP-58 és LPU-01. A pH meghatározásának módszerét és a potenciométerek felszerelésének áramköreit a szerelvényekhez való hozzáadás útmutatója írja le.
A fajtáknál megadott pH-értéken, az erős oxidálószerek és szerek elkerülése érdekében, lehetőség van egy egyszerűbb kivitelű rögzítés beépítésére - a ІМ-2М ionomer (18. ábra). A Diya ionomіru a vimіryuvannі mіlіvoltmetr e.r.s. galvanikus elem zanurenny yogo elektrodіv és doslіdzhuvanii razchiny.
Munkaelektróda az 1. antimon elektróda bemutatásának galváneleméhez, fém-antimonnak látszó edényben. Elektrodóm-beállítás - a klór-ezüst elem értéke 2. A 3 változó magnetoelektromos eszköz skálája millivoltban 0-tól 600-ig, pH-egysége pedig 0-tól 12-ig van beosztva.

Az ionomer pontossága alacsony és ±0,3 pH-n belül van. A stosuvannya yogo azonban lehetővé teszi a pH egyszerű és gyors megváltoztatását széles tartományban (1 és 12 között), sőt, 10 és 35 ° C közötti hőmérsékleti tartományban. Ezenkívül az ionomirhoz nincs szükség elektromos tápegység.
Meg tudod mutatni, hogy egy gazdag betegség kialakulása egy okból áll? Dietológusok és fitoterapeuták gazdagon fahіvtsіv tsyu prihovanu nebezpeka most két szót jelentenek: sav és rét.
A magas savtartalom a szervezet legfontosabb rendszereinek tönkretételét, és a bor immunissá válik a betegségek ellen. A kiegyensúlyozott pH-közép biztosítja az anyagcsere folyamatok normális lebomlását a szervezetben, segítve a betegségek leküzdését. Az egészséges szervezetnek van készlete a tócsás beszédeknek, mint a vikorista boroknak fogyasztáskor.

Spivvіdnoshnja sіvіdnosheniya і luda a kakomu razchinі sav-luzhnoy ryvnovagoynak (KShchR) nevezik, bár a fiziológusok törődnek vele, helyesebb a spіvvіdnoshny tse sav-luzhny tábornak nevezni. A KShchR-t egy speciális pH-mutató (a hidrogén teljesítménye - "a víz ereje") jellemzi, amely megmutatja a vízatomok számát ebben a változatban. 7,0 pH-érték mellett semleges közegről beszélhetünk. Az alacsonyabb pH-érték megegyezik a savanyú közeggel (6,9-től 0-ig). A középső tócsa pH-ja magas (7,1-14,0).
Az ember testének 80%-a vízből áll, ezért a víz az egyik legfontosabb tároló. Az ember teste savasabb-tócsásabb lehet, amit pH (víz) indikátor jellemez. A pH-indikátor értéke a pozitív töltésű ionok (melyek savas közepet alkotnak) és a negatív töltésű ionok (melyek a középső tócsáját alkotják) egyensúlyában rejlenek. Az emberi lény szervezete mindig a megfelelő idő a tse spіvvіdnoshennia, pіdtrimuyuchi pevny rіvіn pH megélésére. Ha az egyensúly megbomlik, személytelen súlyos betegségeket okolhat.
pH, vagy a sav-luzhnoy ї rіvnovagi jelzése.
A víz (H+) és hidroxil (OH-) ionok világszinten megengedett koncentrációjának értéke egy ritka rendszerben, és egy 0-tól (a víz H + ionok extra koncentrációja) 14-ig (hidroxil-ionok túlzott mennyisége OH-) terjedő skálán fejezik ki. ), a desztillált víz fontos pH semleges 7,0.
0 - legerősebb sav, 14 - legerősebb rét, 7 - semleges beszéd.
Valójában bármelyik natív közegben a szervezetben a (H+)-ionok koncentrációjának növekedése tapasztalható, ami a pH-érték savas oldalra tolódását okozza, ami a közeg elsavasodásához vezet. Savas pusztításnak is nevezik.
І navpaki - az (OH-) ionok koncentrációjának növekedése okozta a pH érték holdoldali eltolódását, és a hold zsuv.
Lehet, hogy szervezetünk gyenge közeg. A sav-kenőanyag egyensúlyt szervezetünkben folyamatosan egy stabil szinten és a legszűkebb tartományban tartjuk: 7,26 és 7,45 között. І navit a vér pH-jának jelentéktelen változása, amely meghaladja a közötti pH értéket, betegséghez vezethet.
A pH-egyensúly indikátorainak változása összesítő eredményekhez vezethet.

Megnövekedett savasság a szervezetben.
A helytelen táplálkozás révén a savanyú termékek étrendjébe kerülése, valamint a nem megfelelő víz a szervezet elsavasodásához vezet. Az emberek gazdagon élnek zsírban, húsban, tejtermékekben, gabonafélékben, cukróban, bórban és édességekben, különféle italokban és egyéb feldolgozott, finomított termékekben, ezért célszerű nem bosszút állni a sejtszövetekért, ásványi anyagokért és vitaminokért, látszólag már nem az enzimekről, ill. nem esszenciális zsírsavak.
Ennek ellenállására - a savkoncentráció csökkentésére és a fontos szervek életének meglátására - a szervezet vizet zár be, ami negatívan befolyásolja a beszédcserét: jobban elhasználódik, a bőr kiszárad, ráncos lesz. Ezt megelőzően, amikor a szervezet elsavanyodik, a sav átjutása a szervekbe, szövetekbe rosszabbodik, a szervezet rosszul szerzi be saját ásványi anyagait, és a kettős ásványi anyagok, mint a Ca, Na, K, Mg kiürülnek a szervezetből. A szervezet hatalmas mennyiségű erőforrást és energiát kap a mérgező savak semlegesítésére, ami a biokémiai reakciók egyszerű egyensúlyhiányát okozza. Nyilvánvalóan nem térnek vissza a tócsás tartalékok szilánkjai, amelyeket meg kell hívni, akkor a zavarok szervezete élénkíti belső erőforrásait - kalciumot, magnéziumot, sót, káliumot. Ennek eredményeként a hemoglobin csökken, csontritkulás alakul ki. Ha vért öntenek a hemoglobinba győztesen a sav semlegesítésére, az emberek tudatában lesznek ennek. Amikor kalciumot fogyasztasz, álmatlanságba, drativitásba kerülsz. Az idegszövet lumentartalékának csökkenése következtében a rozum aktivitása megszakad.

Ásványi anyagok hiányában a fontos szervek élete megsérül, a szív- és érbetegségek kockázata megemelkedik, csökken, csontbetegségek és egyéb dolgok jelentkeznek. Mivel nagy mennyiségű sav van a szervezetben, és a kiválasztás mechanizmusai sérülnek (ilyen széklettel, lehelettel, verejtékkel), a szervezet erős mérgezést szenved. Egyetlen levegővétel a test célja.
Világviszonylatban a szervezet elsavasodása több mint 200 (!) borászati bajt okoz, például: szürkehályog, hosszú távú növekedés, ízületi gyulladás, chondrosis, cékla isiász és onkológia!
És az emberek még mindig azon töprengenek: A betegség jelei vannak az emberek között? Miért büdösek? Miért bűzlik az öregségtől?”
Ha valami 90%-nál többre vágyik, érezheti a bűzt - ez "savanyú" termékek, és minden, amitől bűzlik, iszik (tiszta vízből készült tejszín, friss gyümölcslevek és gyógytea zucru nélkül) - legfeljebb pH 4, 5-től 2, 5 - még jobban elsavasítja az emberek szervezetét!
A megnövekedett savasság szakaszát acidózisnak nevezik. Ha az acidózis nem jelentkezik egy óra alatt, az végtelenül károsíthatja a szervezetet, de ha évtizedekig tart, sorsot hozhat.
Ha megtiszteltek ezzel az anyaggal, javasoljuk, hogy olvasóink figyelmébe ajánljuk oldalunk legjobb anyagainak válogatását. Dobіrku - TOP tsіkavih tények és fontos hírek a világból, és különböző fontos dolgokról, amelyeket ott tudhat, ahol a legkényelmesebb az Ön számáraVízindikátor - pH - a vízion világaktivitási indexe (különböző hígítási változatokban koncentrációt mutat) a vízben, ami erősen befolyásolja annak savasságát, a vízion aktivitásának negatív (a kapu előjeléből vett) tizedik logaritmusaként számítják ki, mól per literben kifejezve.
pH = – lg
Minden megértést 1909-ben Sorensen dán vegyész tett. Az indikátort pH-nak nevezik, a latin potentia hydrogeni - a víz erőssége és pondus hydrogenii - a víz vize szavak első betűi után.
A valamivel kisebb szélesség elvette a fordított pH-értéket - a különbség bázikusságának mutatóját, a pOH-t, amely az OH-ionok különbségének koncentrációjának negatív tizedes logaritmusához hasonlítható:
pOH = - lg
Tiszta vízben 25 °C-on a vízben lévő ionok () és hidroxidionok () koncentrációja azonban 10-7 mol/l-t tesz ki, anélkül, hogy zavarná a víz K w állandó autoprotolízisét, más néven ionos oldat. vízből:
K w \u003d 10 -14 [mol 2 / l 2] (25 °C-on)
pH + pOH = 14
Ha mindkét típusú ion koncentrációja azonos az egyedben, úgy tűnik, hogy a faj semleges reakciót válthat ki. Amikor savat adunk a vízhez, megnő az ionok koncentrációja a vízben, és jelentősen megváltozik a hidroxidionok koncentrációja a vízben, amikor a bázist adjuk hozzá - ellenkezőleg, a hidroxidionok helyett mozog, és az ionok koncentrációja vízesésekben f. Ha úgy tűnik, hogy savanyú, de ha tócsa.
Megjelölt pH
A különbségek pH-értékének meghatározására széles körben alkalmazható a spratt módszer.
1) A vízindikátor hozzávetőlegesen megbecsülhető további mutatók segítségével, pH-mérővel pontosan mérve vagy analitikusan a sav-bázis titrálás útján jelezve.
A vízionok koncentrációjának durva becsléséhez a széles körben vikrozó sav-bázis indikátorok szerves beszédbarvniki, amelyek színe a közeg pH-jában rakódik le. A lakmusz, a fenolftalein, a metilnarancs (metilnarancs) és mások a leggyakoribb mutatók előtt állnak. Az egészség jelzői két különböző szennyezett formában - savas vagy bázikus formában. A bőrindikátor színének megváltoztatása a saját savassági intervallumától függ, amely 1-2 egység lesz (1. táblázat, 2. lecke).
A munkaintervallum kiterjesztéséhez a vikoriszt pH-ját univerzális indikátornak kell nevezni, amely az indikátorok matricáinak összege. Az univerzális jelzőfény fokozatosan változtatja a színt pirosról sárgára, zöldre, kékre lilára, amikor savas területről tócsába lép. A ph indikátoros módszerrel történő meghatározása a csapások és a farkú fajták esetében nehézkes.
2) Az analitikai volumetrikus módszer - sav-bázis titrálás - szintén pontos eredményeket ad a különbségek összes savasságának meghatározására. A koncentrációkülönbséget (titrálószert) cseppenként hozzáadjuk a végső szinthez. Amikor megváltoznak, kémiai reakció megy végbe. Az ekvivalencia pont az a pillanat, amikor a titráló pontosan kifogy, hogy a reakciót ismét befejezhessem, ez egy kiegészítő indikátorra van rögzítve. Dali a koncentráció és a titrálónak adott teljes mennyiség ismeretében kiszámítja a mennyiség összes savasságát.
A közeg savassága a személytelen kémiai folyamatok szempontjából fontos, és a túllövés lehetősége, vagy ennek a reakciónak az eredményeként gyakran felhalmozódik a közeg pH-jában. A reakciórendszer pH-értékének megőrzése érdekében a laboratóriumi vizsgálatok során, vagy az életképesség alapján állítsa le a pufferelést, amellyel gyakorlatilag állandó pH-értéket takaríthat meg hígításkor vagy kis mennyiségű sav és víz hozzáadásakor a tartományokhoz.
A vízindikátor pH-t széles körben használják különféle biológiai közegek sav-bázis erejének jellemzésére (2. táblázat).
A reakcióközeg savassága különösen fontos a biokémiai reakciókhoz, például az élő rendszerekben. A vízben lévő ionok koncentrációja gyakran hozzájárul a fehérjék és nukleinsavak fizikai és kémiai erejéhez, biológiai aktivitásához, ami a szervezet normális működéséhez támogatja a sav-bázis homeosztázist és az emberfeletti jelentőségű feladatokat. A biológiai környezet optimális pH-értékének dinamikus fenntartását a pufferrendszerek levegője éri el.
3) Egy speciális tartozék - pH-mérő - segítségével szélesebb tartományban és pontosabban (akár 0,01 pH-egységig) állíthatja be a pH-értéket, további indikátorok esetén alacsonyabb, lehetővé teszi az átlátszatlan pH-érték szabályozását. színváltozatok, és ezért nagyon változatos.
A pH-mérő segítségével megmérik az ionok koncentrációját a vízben (pH) rózsákban, ivóvízben, fűfélékben és szirovinában, a felesleges közeg tárgyaiban és virobnicheskie rendszerekben a technológiai folyamatok megszakítás nélküli vezérlésére, beleértve az agresszív közegeket is.
A pH-mérő nélkülözhetetlen a pH hardveres ellenőrzéséhez az urán és a plutónium tartományában, ha a berendezés jelzése helyes, anélkül, hogy її calіbruvannya szupraszimmetrikusan magas.
A prilad lehet vikoristovuvatisya a laboratóriumokban a helyhez kötött és kellékek, beleértve a szex, valamint a klinikai és diagnosztikai, hajó-egészségügyi, tudományos és fejlett, virobnicheskih, beleértve a hús-és tejtermék-és sütőiparban.
Az óra hátralévő részében a pH-mérőket széles körben használják akváriumi állapotokban, vízminőség-ellenőrzést a szarvasmarháknál, szántóföldi gazdálkodást (különösen a hidroponikában), és - a diagnosztika ellenőrzésére - egészséges leszek.
2. táblázat: pH-értékek különböző biológiai rendszerekre és más típusokra
Találd ki:
Semlegesítési reakció - sav és rét reakciója, melynek eredményeként erős víz oldódik fel;
A vegyészek tiszta víz alatt megértik a vegytiszta vizet, mintha bosszút állnának otthonukért és a sókért, azaz a desztillált vízért.
A közeg savassága
A különböző kémiai, ipari és biológiai folyamatok esetében fontos jellemző a termékek savassága, amely a termékek savasságát és a termékekben lévő savakat jellemzi. Sav szórványai és rétek elektrolitokkal, majd a közeg savasságának jellemzői H + vagy OH - ionokkal keverednek.
A tiszta vízben, bármilyen különbséggel, egyszerre, különböző beszédű részecskékkel vannak H+ és OH- ionok is. Tse vіdbuvaє zavdyaki disotsіatsії samoї vody. І ha vizet akarunk keverni egy nem elektrolittal, a fehérje disszociálható: H 2 O ^ H + + OH -. Pedig ez a folyamat jelentéktelen világnak tűnik: 1 liter vízben csak 1 esik szét. 10-7 mol molekula.
Különböző savakban a disszociáció eredménye additív H+ ionok. Az ilyen fajtákban a H+ ionok lényegesen nagyobbak, az alacsonyabb OH - ionokat, amelyek a víz jelentéktelen disszociációjára rendezkedtek be, savasnak nevezzük (11.1. ábra, zliva). Szokás mondani, hogy az ilyen rózsáknak savas közepe van. Minél több H+ ion keveredik, annál savasabb a közeg.
Különböző réteken viszont disszociáció után az OH - ionok érvényesülnek, és a H + kationok a víz jelentéktelen disszociációja révén napi lehetnek. Az ilyen fajtájú tócsák közepe (11.1. ábra, jobbos). Ha az OH - ionok koncentrációja nagyobb, mint az átlag, akkor ez a különbség közepe.
Különféle konyhai sókban a H + és OH ionok mennyisége azonos és drágább 1. 10-7 mol 1 literben. Az ilyen középpontot semlegesnek nevezzük (11.1. ábra, középpont). Valójában ez azt jelenti, hogy a rózsák nem bosszulják meg a savat, sem a rétet. A semleges közeg inkább az aktív sók (réti és erős savval megszilárdult) és gazdag szerves rechovin jelenlétére jellemző. A tiszta víznek semleges központja is van.
Víz kijelző
Ha szeretné megízlelni a kefir és a citromlé ízét, akkor bátran keményítheti azt a citromlevet, amely gazdagon savanykás, így ezeknek a változásoknak a savassága eltérő. Azt már tudod, hogy a tiszta vízben H+ ionok is vannak, de a víz savanyú íze nem ízlik. A H+ ionok koncentrációja is alacsony. Gyakran nem elég azt mondani, hogy a közeg savas vagy tócsás, hanem tömören jellemezni kell.
A közeg savasságát jól jellemzi a vízindikátor pH (jelentése „pe-hamu”), amely a koncentrációtól függ.
ionok a hidrogénben. A pH-érték a hidrogénben lévő kationok mennyiségétől függ 1 literben. Tiszta vízben, semleges tartományban, 1 litert kell eltávolítani 1 . 10 7 mol H+ ion, a pH érték pedig közelebb van a 7-hez. A H+ kationok koncentrációja a savas fajtákban magasabb, a tiszta vízben alacsonyabb, a tócsás fajtákban kisebb. A víz pH-mutatójának értéke bizonyos mértékig változik: savas közegben 0 és 7 között, a tócsákban pedig 7 és 14 között mozog. Korábban a vízindikátort Peder Sørensen dán kémikus terjesztette.
Emlékezhet, hogy a pH-érték a H+-ionok koncentrációjával függ össze. A pH értéke közvetlenül összefügg egy szám logaritmusának kiszámításával, ahogy a 11. osztályban is tetted a matematika órákon. Az Ale vzaimozv'yazok mizh vistom ionіv különböző pH-értékeken nyomon követhető a támadósémához:


A vízfajták pH-értéke a legtöbb beszéd- és természetes változatban 1 és 13 között van (11.2. ábra).

Rizs. 11.2. Különféle natúr és darabos fajták pH értéke

Soren Peder Lauritz Sorensen
Dán fizikokémikus és biokémikus, a Dán Királyi Szövetség elnöke. A Koppenhágai Egyetemen végzett. 31 évesen a Dán Politechnikai Intézet professzora lett. A Koppenhága melletti Carlsberg sörfőzde tekintélyes fizikai és kémiai laboratóriumát nyitotta meg, bemutatva vezető tudományait. A főbb tudományos tevékenységek a különbségek elméletéhez kapcsolódnak: a vízindikátor (pH) megértése, az enzimek aktivitásának fontossága és a különbségek savassága közötti különbség. A tudományos eredményekért Serensen hozzájárult a „XX. század 100 kiemelkedő vegyésze” listájához, és a tudománytörténetben a borok mint tanítások lemaradtak, ami lehetővé tette a „pH” és a „pH-metria” megértését. .
A közeg savasságának megjelölése
A laboratóriumi eltérések savasságának meghatározására a leggyakoribb helyettes indikátor az univerzális indikátor (11.3. ábra). Ennél a farbuvannyamnál nemcsak a savasság jelenléte határozható meg, hanem a pH-érték is 0,5-ig változhat. A pH pontos mérésére speciális berendezést használnak - pH-mérőt (11.4. ábra). A szagok lehetővé teszik a pH érték pontos beállítását 0001-001-ig.
Vicorist indikátorok vagy pH-mérők segítségével mérhető a kémiai reakciók lefolyása. Például, ha sósavat adunk a nátrium-hidroxidhoz, akkor semlegesítési reakció lép fel:

Rizs. 11.3. Az univerzális indikátor megközelítőleg a pH-értéket mutatja

Rizs. 11.4. A victorium analízisének pH-értékének szabályozására speciális eszközöket használnak - pH-mérők: a - laboratóriumi (helyhez kötött); b - hordozható
Ily módon a reagensek és a reakciótermékek sokfélesége meddő. Ha a pH-mérő elektródáját a szántóföldre helyezi, akkor a beállított érték pH-értékei alapján ítélheti meg a rét savval történő semlegesítésének mértékét.
A vízkijelző leállítása
Az eltérések savasságának jelentősége a tudomány, az ipar és az élet egyéb szféráiban gazdag gyakorlati jelentőséggel bírhat.
Az ökológusok rendszeresen ellenőrzik a folyóvizek, folyóvizek és tavak pH-értékét. A természetes vizek savasságának meredek növekedését okozhatja a felhős légkör, vagy az ipari vállalkozásoknál a víztározók közelében történő fogyasztás (11.5. ábra). Az ilyen változások a roslinok, bordák és más zsákolók pusztulását okozzák a vízben.
A vízmegjelenítés fontosabb az élő szervezetekben végbemenő folyamatok megelőzésében, amelyekre a sejtekben számszerű kémiai reakciók mennek végbe. A klinikai diagnosztikában a vérplazma pH-ja, a keresztmetszet, a nyálkahártyalé, ill. (11.6. ábra). A vér normál pH-ja 7,35-7,45. Az ember vérének pH-értékében kismértékben megváltozik, súlyos betegséget okozva, és pH = 7,1 és ennél alacsonyabb értéknél visszafordíthatatlan változások indulnak el, amelyek halálhoz vezethetnek.
A növekedés nagy része a talaj savassága szempontjából fontos, ezért az agronómusok messze elmaradnak a pH-jukat meghatározó talajelemzés elvégzésétől (11.7. ábra). Mivel a savasság túl magas egy énekes kultúrához, a talaj párolog, ami növeli a hitet vagy gőzölést.
Az élelmiszeriparban sav-bázis mutatók segítségével ellenőrizni kell az élelmiszerek minőségét (11.8. ábra). Például a tej pH-jának normája = 6,8. Vіdhilennya vіd tsgogo znachennya svіdchit vagy a harmadik féltől származó házak jelenlétéről, vagy a yogo savanyúságról.

Rizs. 11.5. A vízi utak közelében lévő víz azonos pH-jú beáramlása a bennük lévő növedékek életére

A kozmetikai termékek pH-értéke fontos, mivel ez helyettesíti a tokot. Az emberi bőr átlagában pH = 5,5. Ha a shkir érintkezik az eszközökkel, akkor ezeknek a savassága és a savtartalma az értéktől függően változik, ezért valószínűbb, hogy a régi shkir érintkezik, esetleg gyulladt. Megállapították, hogy a pralén, mint egy trivaly óra, győztesen a pránnyához különösen gyengédek voltak (pH = 8-10) vagy szódával (Na 2 CO 3, pH = 12-13), a kezek bőre jobban lett. száraz és repedezett. Ezért fontos a különböző kozmetikai termékek (zselék, krémek, samponok) használata, amelyek pH-értéke közel áll a bőr természetes pH-értékéhez.
LABORATORIES DO SVIDI № 1-3
Felszerelés: állvány kémcsövekkel, pipetta.
Reaktív: víz, kloridsav, NaCl, NaOH, nátrium-klorid, univerzális indikátor (különféle vagy indikátorpapír), élelmiszer- és kozmetikai termékek (pl. citrom, sampon, fogkrém, por, szénsavas víz, levek vékonyan).)
Biztonsági szabályok:
A végső győzelemhez használjon kis számú reagenst;
Ügyeljen a reagensek használatára a bőrön, a szemen; ütési їdkoї beszéd esetén її її її її її її її її її її її її ії її її vodka.
Hidrogénionok és hidroxid-ionok kinevezése rozchinyben. Hozzávetőleges pH-érték beállítása vízhez, tócsához és savas oldatokhoz
1. Öt kémcsőbe öntsön egyenként 1-2 ml-t: az 1-es számú kémcsőbe - víz, a 2-es számú - a kloridsav, a 3-as számú - a nátrium-klorid, a 4-es - a nátrium-hidroxid és az 5-ös számú - táblázat. zab.
2. Adjon 2-3 csepp univerzális indikátort a bőrkémcsőbe, vagy hagyja ki az indikátorpapírt. Vyznacht pH razchinіv, porіvnyuyuchi színe a mutató a referencia skála. Ha többet szeretne megtudni a kationok jelenlétéről a bőrmintákban: Hidrogén vagy hidroxid-ionok. E spoluk egyenlő disszociációjának tárolása.
Dosledzhennya pH grub és kozmetikai termékek
Próbálja ki az élelmiszer- és kozmetikai termékek univerzális mutatóját. A száraz beszéd fenntartásához például a megfelelő port kell kis mennyiségű vízben elkeverni (1 spatula száraz beszéd 0,5-1 ml vízhez). Határozza meg a különbség pH-értékét. Gyűjteni visnovki a savasság a közepén a bőr a múltban termékek.
Kulcs ötlet

A táplálkozás szabályozása
130. Valamilyen ion jelenlétét egy kiskereskedőben a savasság határozza meg?
131. Hogyan szabadulnak meg a feleslegtől savas körülmények között? a tócsáknál?
132. Milyen mutató jelzi egyértelműen a kompozíciók savasságát?
133. A pH és a vegyes H+ ionok értékéhez hasonlóan fajtáknál: a) semleges; b) enyhén savas; c) gyengeelméjű; d) erősen savas; e) erős?
Feladat az anyag elsajátítására
133 Mely ionok gyakoribbak a különböző országokban: H+ chi OH - ?
135. Két kémcsőben van különbség a nitrátsav és a kálium-nitrát között. Milyen mutatókkal lehet kacsintgatni a vyznachennyára, milyen mintavevők találhatnak sót?
136. Három kémcsőben különbségek vannak a bárium-hidroxid, a nitrátsav és a kalcium-nitrát között. Hogyan lehet tudni és kideríteni egyetlen reagens segítségével?
137. A javaslatból írja le a beszédek képleteit, amelyek közötti különbség a közepe lehet: a) sav; b) tócsa; c) semleges. NaCl, HCl, NaOH, HNO 3, H 3 PO 4, H 2 SO 4, Ba(OH) 2, H 2 S, KNO 3.
138. Doshchova víz pH = 5,6. Mit jelent? Milyen beszéd az, ami a levegőben rejtőzik, amikor más a vízben, akkora közepe savasságát mutatja?
139. Yake közép (sav vagy tócsa): a) samponban (рН = 5,5);
b) egészséges ember vérében (рН = 7,4); c) emberi kagylólé (рН = 1,5); d) a szánban (рН = 7,0)?
140. A hőerőműveknél megkoronázott kővugill raktárában félkegyelmű nitrogén és kén található. A vugillya lepattogzási termékeinek légkörbe történő kibocsátását a savanyú fákra vonatkozó következtetésig kell elvégezni, hogy kis mennyiségű nitrát- vagy szulfátsav eltávolítható legyen. Milyen pH-értékek jellemzőek egy ilyen folyóvízre: több mint 7 vagy kevesebb, mint 7?
141. Hogyan határozható meg egy erős sav pH-értéke koncentrációjában? Vidpovid pakolás.
142. Annyira, hogy 1 mól kálium-hidroxidot kell pótolni, a fenolftaleint adtuk hozzá. Chi zaminitsya zabarvlennya tsgogo rozchiny, akshcho klórsavat adni kіlkіstyu rechovina: a) 0,5 mol; b) 1 mol;
c) 1,5 mol?
143. Három írás nélküli kémcsőben nincs nátrium-szulfátot, nátrium-hidroxidot és szulfátsavat tartalmazó palack. Minden fajtánál mértük a pH-értékeket: az első mintában - 2,3, a másikban - 12,6, a harmadikban - 6,9. Van néhány szondának valamilyen beszéde?
144. Megtanult egy gyógyszertárban desztillált vizet vásárolni. pH-mérő, amely azt mutatja, hogy a pH-érték 6,0. Ezután tanuljuk meg hosszan forralni a vizet, az edényt a tetejéig megtöltve forró vízzel, és lezárva a fedelet. Ha a víz szobahőmérsékletűre hűlt, a pH-mérő 7,0 értéket mutat. Miután a következő szondás diák újra átengedte a vízen, a pH-mérő ismét 6,0-t mutatott. Hogyan magyarázhatom el ezeknek a pH-méréseknek az eredményeit?
145. Honnan tudod, hogy egy virobnik két golyójának miért lehet eltérő pH-értéke?
Az asszisztens anyaga
Bármilyen okból, savtócsának nevezik egyenlőnek ( KShchR), bár a fiziológusokat érdekli, mi a helyes neve a spivvіdnoshenya sav-hold tábornak.
A KShchR-t egy speciális pH-mutató (power Hidrogén - "víz erőssége") jellemzi, amely megmutatja a vízatomok számát egy adott fajtában.
7,0 pH-érték mellett semleges közegről beszélhetünk.
Csökkentse az alacsonyabb pH-értéket- csapat középsavanyú(Vid 6,9-0).
A középső tócsa pH-ja magas (71-140 faj).
Egy személy teste 70%-a vízből származik ahhoz a víz az egyik legfontosabb tároló.
Az ember teste savasabb lehet, ha köpködik, amit a pH (víz) indikátor jellemez.
A pH-indikátor értéke a pozitív töltésű ionok (melyek savas közepet alkotnak) és a negatív töltésű ionok (melyek a középső tócsáját alkotják) egyensúlyában rejlenek.
Szervezze zavzhdi prіvnovazhit tse spivvіdnoshennia, pіdtrimuyuchi pevny rіven pH.
Ha az egyensúly megbomlik, személytelen súlyos betegségeket okolhat.
 Fordítsa meg a sav-kenőanyag egyensúlyt további pH-teszthez.
Fordítsa meg a sav-kenőanyag egyensúlyt további pH-teszthez.
Ennél is fontosabb odafigyelni a szervezet belső környezetének pH-értékének változására, a szükségletre, az előre nem látható látogatásokban élni.
További segítségként a pH-tesztelő férj egyszerűen, gyorsan és pontosan meg tudja mérni a pH-értéket anélkül, hogy elhagyná a házat.
A pH-szint meghatározására a legalkalmasabb óra 1 évvel előtte vagy 2 év után.
Naponta 2-3 alkalommal ellenőrizze a pH-értéket.
A saját pH-szintjének nem ismerete összegezéshez vezethet.
A) Megnövekedett savasság a szervezetben
A szervezet pH-egyensúlyának felborulása a legtöbb embernél nyilvánvalóan megnövekedett savasságban nyilvánul meg (stand Acidózis).
Ebben az országban a test mocskosan megszerzi az ásványi anyagokat, például a kalciumot, a nátriumot, a káliumot és a magnéziumot, valamint a felesleges savasságot, és kiürül a szervezetből.
Ásványi anyagok hiányában a fontos szervek élete megsérül.
Ha az acidózis nem jelentkezik egy óra alatt, az végtelenül károsíthatja a szervezetet, de ha évtizedekig tart, sorsot hozhat.
Az alkohollal való visszaélés gyakran acidózishoz vezet.
Acidózis feltehető a cukorbetegség súlyosbodásaként.
Az acidózis esetén a következő problémák okolhatók:
B) Mozgás a réteken a testben
Amikor a rét megmozdul a testben, és az egész tábort hívják Alkalózis, Tehát csakúgy, mint az acidózisban, az ásványi anyagok asszimilációja megsemmisül.
Még gazdagabb lesz, ami lehetővé teszi, hogy a méreganyagok a bélrendszerből a vérbe hatoljanak.
A testben a réten való mozgás nem biztonságos, és fontos előre haladni.
Általában a rétet söprő likiv termesztésének eredménye.
A réten való mozgás provokálhatja:
PH érték
A pH-szakasz tesztek eredményei azt mutatják, hogy a szervezet milyen jól szerzi be az ásványi anyagokat, például a kalciumot, nátriumot, káliumot és magnéziumot.
Ezeket az ásványi anyagokat "savcsillapítóknak" nevezik, a bűzszilánkok szabályozzák a szervezet savasságának szintjét.
Mivel a savasság magas, a szervezet nem termel savat.
A bor képes semlegesíteni a savat.
Amely szervezet számára elkezdenek ásványi anyagokat tartalékolni különféle szervekből, kefékből és egyéb. a felesleges sav semlegesítésére, mivel az elkezd felhalmozódni a szövetekben.
Ezenkívül szabályozni kell a savasság szintjét.
Vizoros ásványok a savak semlegesítésére
A Kaliforniai Egyetemen (San Francisco) 7 éven keresztül nyomon követést végeztek, 9 tiszafát debulíroztak. nő.
Az eredmények azt mutatták, hogy a savasság állandó növekedésével az ecsetek törékennyé válnak.
Fahіvtsі, yakі végezte ezt a kísérletet, upevnіnі, scho a középkorú nők legtöbb problémája a zayvim vzhivannâ m'yasnoї és a nіstache vіvvannija ovocheva їzhі következménye.
Ennek a szervezetnek nincs hiánya semmiben, hiszen kiveszi a kezéből a kalciumot, és ehhez segít a pH-szint szabályozásában.
(American Journal of Clinical Living).
PH érték

A fészer pH-értékének ismerete is ésszerű.
A vizsgálat eredményei a gyógynövényi traktusban, különösen a májban és a csatornában lévő enzimek aktivitását mutatják.
Ez a pokasnik az egész test egészének munkájáról ad tájékoztatást, így a többi rendszerről is.
Deyakі emberek anya podvischenu savasság, mint a sechі, így і ribanc - ilyen idő alatt lehetséges, hogy jogosan z podvіynoyu savasság.
A vér pH-értéke

A vér pH-ja a szervezet egyik legfontosabb fiziológiai állandója.
Normál esetben a mutató a határon változtatható 7,3b - 7,42.
Ennek a pokazanniknak a megsemmisítése, ha csak 0,1-gyel is, súlyos patológiához vezethet.
Amikor a vér pH-értéke 0,2-re megsemmisül, kóma alakul ki, és 0,3 -kal - egy személy gyne.
Szerezze meg a megfelelő pH-egyensúlyt a mentális egészség érdekében
Az épület szervezete csak megfelelő szintű sav-luzhnoy szinten képes megszerezni és felhalmozni az ásványi anyagokat és a beszédéletet.
Tegyen meg mindent, hogy segítsen a testének megszabadulni tőle, és ne használjon barna szavakat.
Például, zalizo talán meghódítani organizmus pH-n 6,0 - 7,0 , A jód- pH-n 6,3 - 6,6 .
Testünk vikorista sósav sünök hasítására.
Az életfolyamat során a szervezet savasként és bomlástermékek tócsáit fogyasztja, és az előbbiek 20-szor jobban oldódnak, alacsonyabbak, mint mások.
Ezért szükséges, hogy a szervezet rendszere, amely biztosítja a yogo KShchR megváltoztathatatlanságát, „végzett” minket a semlegesítés és a savas bomlástermékek eltávolítása előtt.
A tsієї rivnovagi támogatásának fő mechanizmusai є:
Az Ön érdeke a megfelelő pH-egyensúly fenntartása.
A „legjobb” program megtalálása a lédús fűszernövények szedéséhez nem hatékony, ha a pH-egyensúly hibás.
Hogyan figyeli a szervezet az egyenlő savasságot
BAA a szervezet ph-egyensúlyának normalizálására:
 Állítsa helyre a növényi enzimhiányt Állítsa helyre a növényi enzimhiányt Az élő beszédek polypshuyut felosztása és asszimilációja Normalizálja a gyógynövényrendszer szerveinek működését Szabályozza a sósav szintjét a tömlőnél Normalizálja a bélrendszer mikroflóráját Javítsa meg az ütésgátlót Szabályozza a sav-kenőanyag egyensúlyt a szervezetben 120 kapszula | 21,56 dollár |
Hasonló cikkek